この記事では、電池の仕組みと、構成する部材について紹介します。
電池の基本的な仕組み:化学エネルギーから電気エネルギーへの変換
電池は、化学エネルギーを電気エネルギーに変換することで電気を発生させる装置です。
電池内部では、酸化反応と還元反応が起こり、電子の移動によって電流が流れます。
この仕組みによって、私たちが使うさまざまな機器に電力を供給することができます。
電池の基本構造と役割
電池は、エネルギーを化学的に蓄え、それを電気エネルギーとして取り出す装置です。
化学電池であれば、どの種類の電池でも基本的な構成要素は共通しています。
電池を構成する主要な部品は以下の4点に分けることができます。
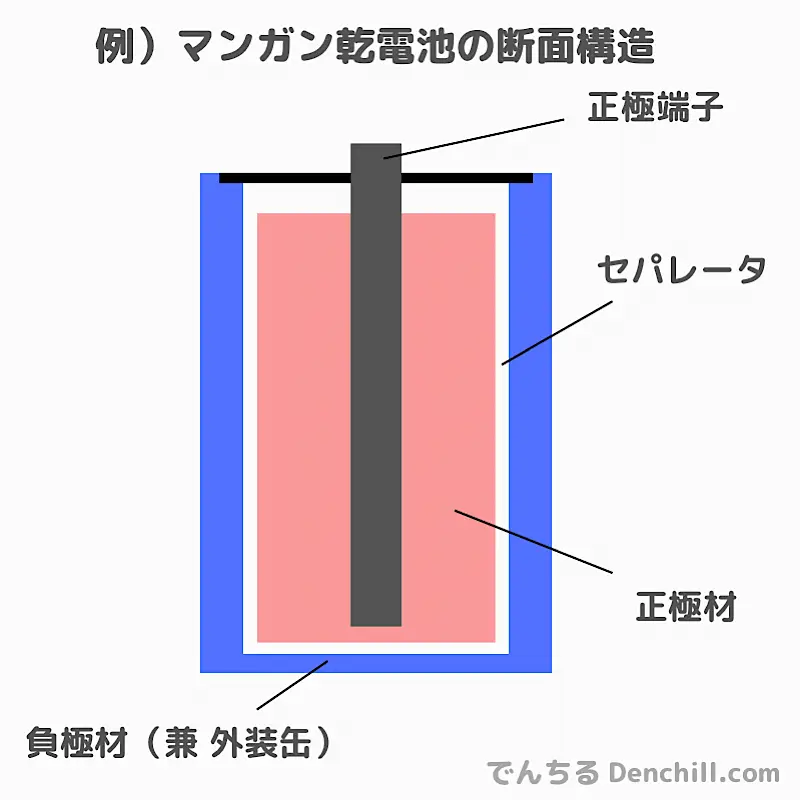
- 正極
- 負極
- 電解質
- セパレータ
これらの部品は、電池として必要な最小構成要素です。
このほかにも、外装や集電体や端子などもありますが、ここでは上記の4点について詳しく解説します。
正極・負極の役割と材料の種類
正極と負極は、電池の中で化学反応を起こして電気を生み出す中心的な部品です。
正極と負極は、電池の中で次のような役割をしていますり
- 正極(カソード)
-
正極は電子を受け取る電極です。
電池内部では、正極で「還元反応(電子を受け取る反応)」が発生します。
- 負極(アノード)
-
負極電子を放出する電極です。
電池内部では、負極で「酸化反応(電子を放出する反応)」が発生します。
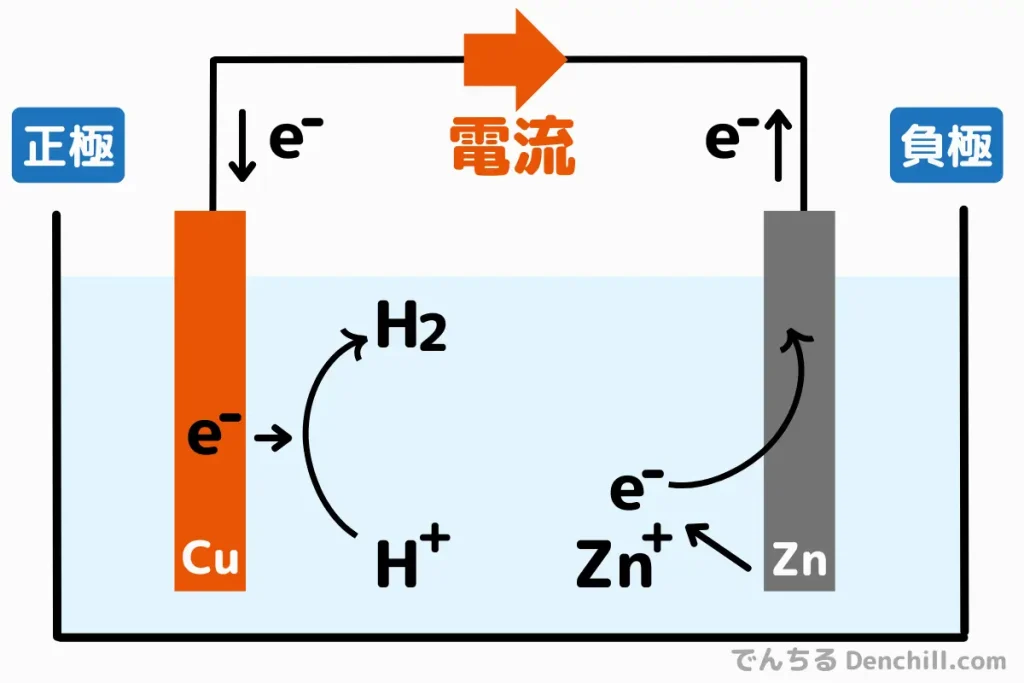
正極は電子を受け取り(還元反応)、負極は電子を放出する(酸化反応)ことで、外部回路に電流を供給します。ひっくるめて酸化還元反応といい、化学電池は基本的にこの二つの反応によって成り立っています。
正極と負極には、それぞれ異なる材料が使用され、その組み合わせによって電池の電圧や特性が大きく変わります。
- 正極材料
-
基本的に、酸化状態の高く、還元されやすい化合物が正極の材料となります。
例えばマンガン乾電池では二酸化マンガン(MnO2)が使用されています。
- 負極材料
-
基本的には、酸化状態が小さく、酸化されやすい化合物が負極材料として用いられます。
マンガン乾電池では亜鉛(Zn)が用いられます。
また、今ではよく使われているリチウムイオン電池は、正極にはコバルト酸リチウム、負極はカーボンが用いられていますが、電極そのものが反応するわけではありません。
正極と負極は層状の構造をしていて、電解液を漂っているリチウムイオンが正極に入ったり負極に入ったりと、両極の層間を行き来することで電子のやり取りをしています(インターカレーション反応)。
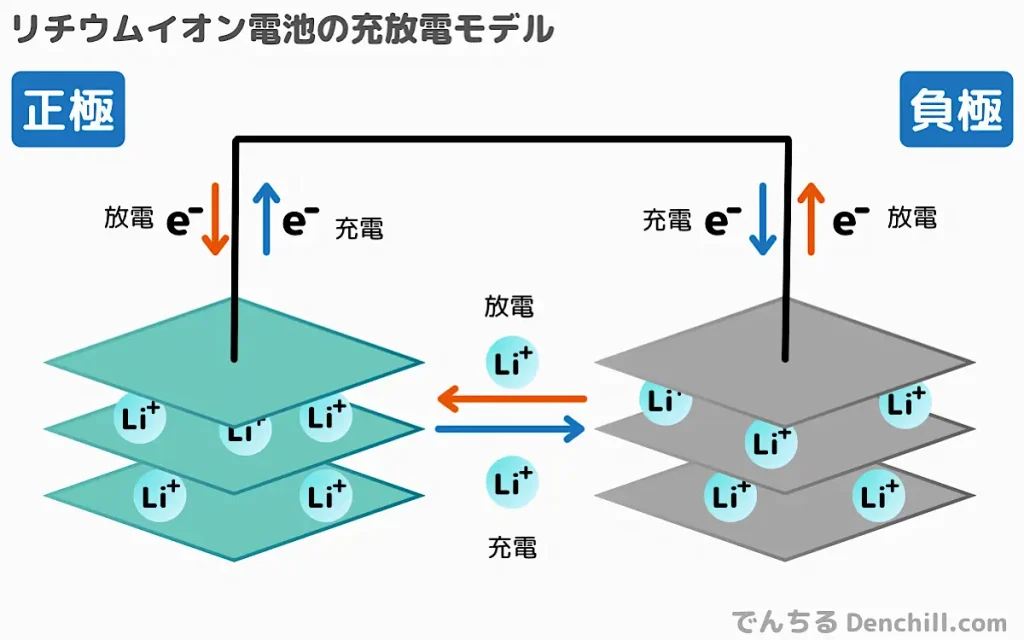
このようにインターカレーション反応を利用した電池は「ロッキングチェア型」といいます。
反対にマンガン乾電池のように電極そのものが溶けたり析出したりして電子のやり取りをするタイプは「溶解析出型」の電池です。
燃料電池やレドックスフロー電池のように、炭素でできた電極上で電解液中の分子やイオンが化学反応をすることで電流が発生するものもあります。
つまり、電池には
- 電極そのものが反応する電池
- 電極は物質が反応する媒体となっている電池
- またはそれらが組み合わさった電池
もあるのです。
電解質の機能と種類
電解質は、電池の内部で正極と負極の間で、電極反応に必要なイオンや電子を移動させる役割を担っています。
このイオンの移動が電気を生み出すため、電解質の特性は電池の性能に大きく影響します。
液体電解質
一般的に、”水系”と”非水系(有機系*)*”に分けられます。
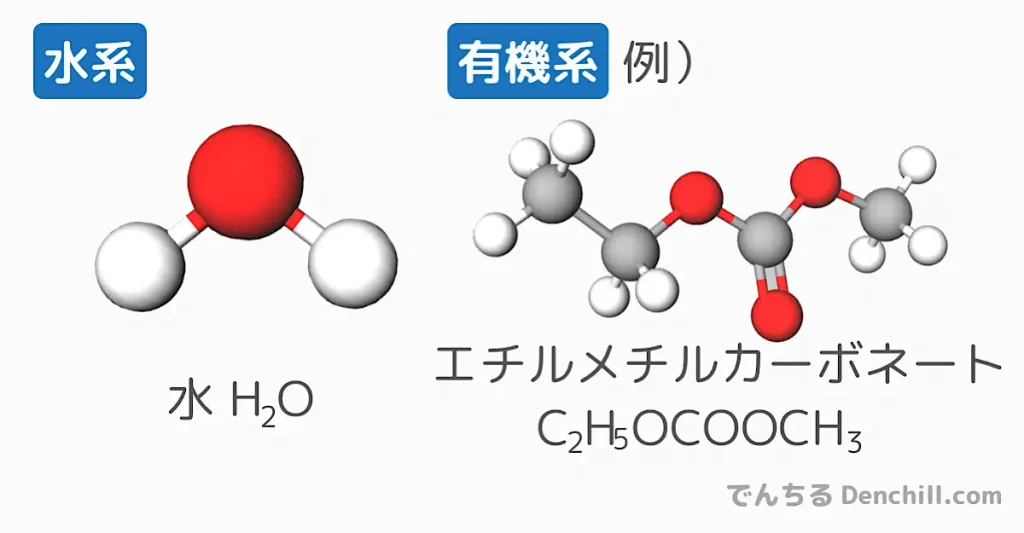
- ”水系”電解質
-
アルカリ電池やニッケル水素電池などは”水系”に分類されます。電気を通しやすい水系電解質は高い伝導性を持つので、抵抗が低く大電流を取り出しやすくなります。
一方で、水の電気分解が起きてしまいますので、高電圧は得づらく、最大1.5V程度が限界となります。
- ”非水系”電解質(有機系電解液)
-
リチウムイオン電池では有機溶媒を使用した液体電解質が一般的です。高いイオン伝導性を持ちますが、水系には劣ります。そのため、電池の内部抵抗は水系に比べて高くなる傾向があります。
しかし、水系のように低い電圧で分解しないため、高電圧・高容量で、エネルギー密度の電池を作りやすくなります。
しかし、材料の多くが可燃性のため、安全性に課題があります。
ゲル電解質

液体と固体の中間の性質を持ち、漏れにくく安全性が高いのが特徴です。ただし、液体電解質よりも電気伝導性は劣ります。
モバイル機器に用いられるリチウムポリマー電池などがこれにあたります。
固体電解質
固体電解質をもった、全固体電池は次世代電池の有力候補です。高エネルギーと実現しながらも、燃えにくく安全性が高い反面、イオン伝導性が低いことが課題となっています。
また、どうしても電極と電解質の間に界面が生じるので、そこがはがれてしまうと抵抗が顕著に上がってしまうなど、まだまだ課題が残っています。
セパレーターと外装の役割
セパレーターは正極と負極を物理的に隔て、電池内部で短絡(ショート)防ぐための部品です。同時にイオンは透過させる必要もあります。
イオンや電子だけを通す機能があったり、微細な孔を持つ特殊な膜が使われます。耐熱性や強度が求められ、安全性に直結する重要な部品です。
外装は電池全体を保護する役割を持ち、金属缶やラミネートフィルムが使われます。
外装の構造や材質は、電池の形状や用途によって異なります。
例えば、スマートフォンには薄型軽量なラミネート型が採用され、電気自動車には強度が高く冷却効率の良い金属缶が使われることが多いです。
電池で電気が生まれる仕組みとプロセス
電池が電気を生み出す過程は、以下の3つのステップに分けられます。
① 化学反応の発生(酸化還元反応)
電池の内部では、負極(アノード)で酸化反応が、正極(カソード)で還元反応が発生します。
このとき、電子が負極から放出され、正極へと流れ込もうとします。マンガン乾電池を例に見てみましょう。
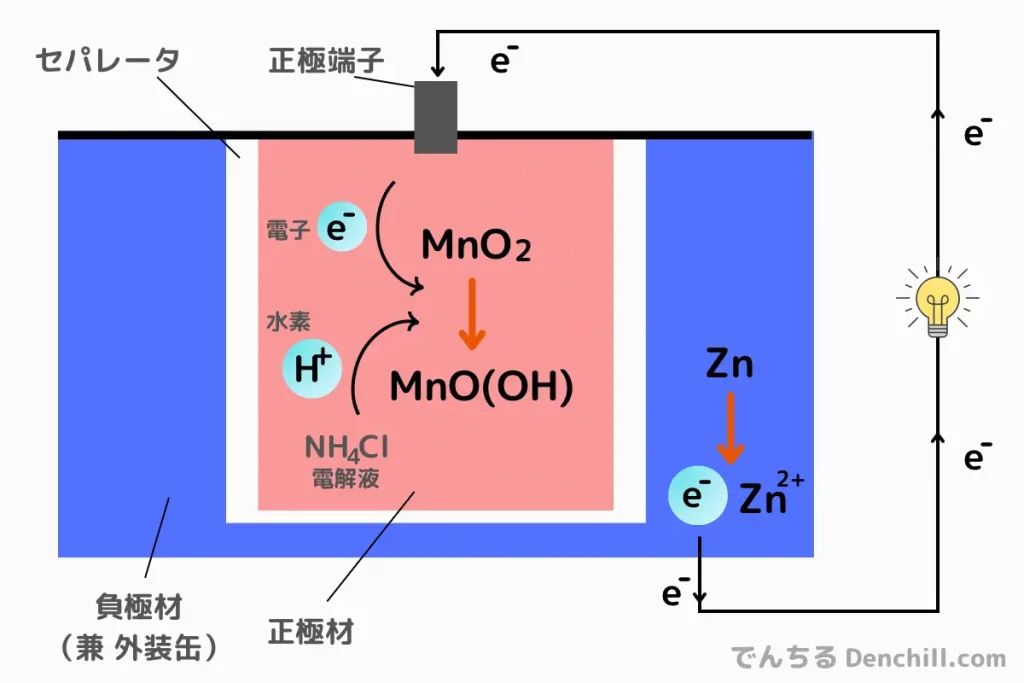
- 正極(カソード)での還元反応
-
MnO2+H2O+e−→MnO(OH)+OH-
(電子を受け取る) - 負極(アノード)での酸化反応
-
Zn→Zn2++2e–
(電子を放出)
この反応によって、負極で生じた電子が外部回路を通って正極へ移動します。
② 電子の移動(外部回路を通る)
電子は、電池の内部を直接移動するのではなく、外部回路を通って負極から正極へ移動します。
この電子の流れが、電気エネルギーを生み出し、電気を使う機器へと供給されます。
- 重要なポイント
-
- 電池の内部では、電子またはイオンが移動して電荷のバランスを保つ。
- 外部回路を通る電子の流れが電流となる。
③ 電流の発生(電子の流れが電流になる)
電子が外部回路を流れることで、電流(電荷の流れ)が発生します。
この電流を利用することで、さまざまな機器に電力を供給することができます。
例えば、電球を点灯させる場合:
- 負極(アノード)から電子が外部回路へ流れる。
- 電子が外部回路を流れることで電流が発生し、電球が光る。
- 正極(カソード)へ電子が流れ込み、還元反応が起こる。
この一連の流れによって、電池は機器へ電力を供給し続けることができます。
電池の種類ごとの構成の違い
電池にはさまざまな種類があり、それぞれ構成要素や特徴が異なります。
以下に主な電池の種類を載せていますが、これはほんの一例です。
一次電池の構成の例
| 電池の種類 | 正極材料 | 電解液 | 負極材料 |
|---|---|---|---|
| マンガン乾電池 | 二酸化マンガン (MnO₂) | 塩化アンモニウム (NH₄Cl) + ZnCl₂水溶液 | 亜鉛 (Zn) |
| アルカリ乾電池 | 二酸化マンガン (MnO₂) | 水酸化カリウム(KOH) 水溶液 | 亜鉛 (Zn) |
| リチウム一次電池 | 二酸化マンガン (MnO₂) / フッ化炭素 (CFₓ) | 有機電解液 (LiPF₆ など) | リチウム金属 (Li) |
| 空気電池 (Zn-空気電池など) | 空気中の酸素 (O₂) / 二酸化マンガン (MnO₂) | 水酸化カリウム (KOH) 水溶液 | 亜鉛 (Zn) |
| 銀電池 (酸化銀電池) | 酸化銀 (Ag₂O) | 水酸化ナトリウム (NaOH) 水溶液 | 亜鉛 (Zn) |
一次電池では、一度放電すると正負極の物質が簡単には元に戻らない状態になってしまいます。
それゆえに、もう一度充電して使用するのが不可能です。
二次電池(充電可能)の構成の例
| 電池の種類 | 正極材料 | 電解液 | 負極材料 |
|---|---|---|---|
| 鉛蓄電池 | 二酸化鉛 (PbO₂) | 希硫酸 (H₂SO₄) | 鉛 (Pb) |
| ニッケル水素電池 (Ni-MH) | オキシ水酸化ニッケル (NiOOH) | 水酸化カリウム (KOH) 水溶液 | 水素吸蔵合金 (MH) |
| リチウムイオン電池 (Li-ion) | LiCoO₂ / LiFePO₄ / LiMn₂O₄ など | 有機電解液 (カーボネート系溶媒) およびLiPF6 | グラファイト (黒鉛) |
| 全固体電池 | LiCoO₂ / LiFePO₄ / LiMn₂O₄ など | 硫化物系 / 酸化物系 / ポリマー系固体電解質 | グラファイト / リチウム金属 |
| ナトリウム硫黄電池 (Na-S電池) | 硫黄 (S) | アルミナ固体電解質 (β-Al₂O₃) | ナトリウム (Na) |
| フロー電池 (レドックスフロー電池) | 炭素 | 硫酸バナジウム水溶液 | 炭素 |
二次電池は放電後の正負極の物質が再度元の状態に戻すことが簡単で、繰り返し充放電が可能となります。
まとめ

電池は、正極・負極・電解質・セパレータといった基本構成要素によって成り立っており、それぞれが電池の性能や寿命、安全性に大きく影響を与えています。
今後も電池技術の発展により、より高性能で安全な電池が登場することが期待されます。

